PARP1(poly [ADP-ribose] polymerase 1)は、ヒトではPARP1遺伝子にコードされる酵素である。NAD ADP-ribosyltransferase 1、poly[ADP-ribose] synthase 1などの名称でも知られる。 PARPファミリーの酵素の中で最も豊富に存在し、このファミリーに利用されるNAD のうち90%をPARP1が占める。PARP1は大部分が細胞核に存在するが、一部は細胞質基質に存在することも報告されている。
機能
PARP1はNAD を用いてポリADPリボース(PAR)を合成し、タンパク質に転移する(ADPリボシル化)。PARP1はDNA損傷の修復の他、炎症の誘導や1型糖尿病の病理にも関係している。また、PARP1は胃がんの発生ならびに増殖時にピロリ菌Helicobacter pyloriによって活性化される。
DNA損傷修復における役割
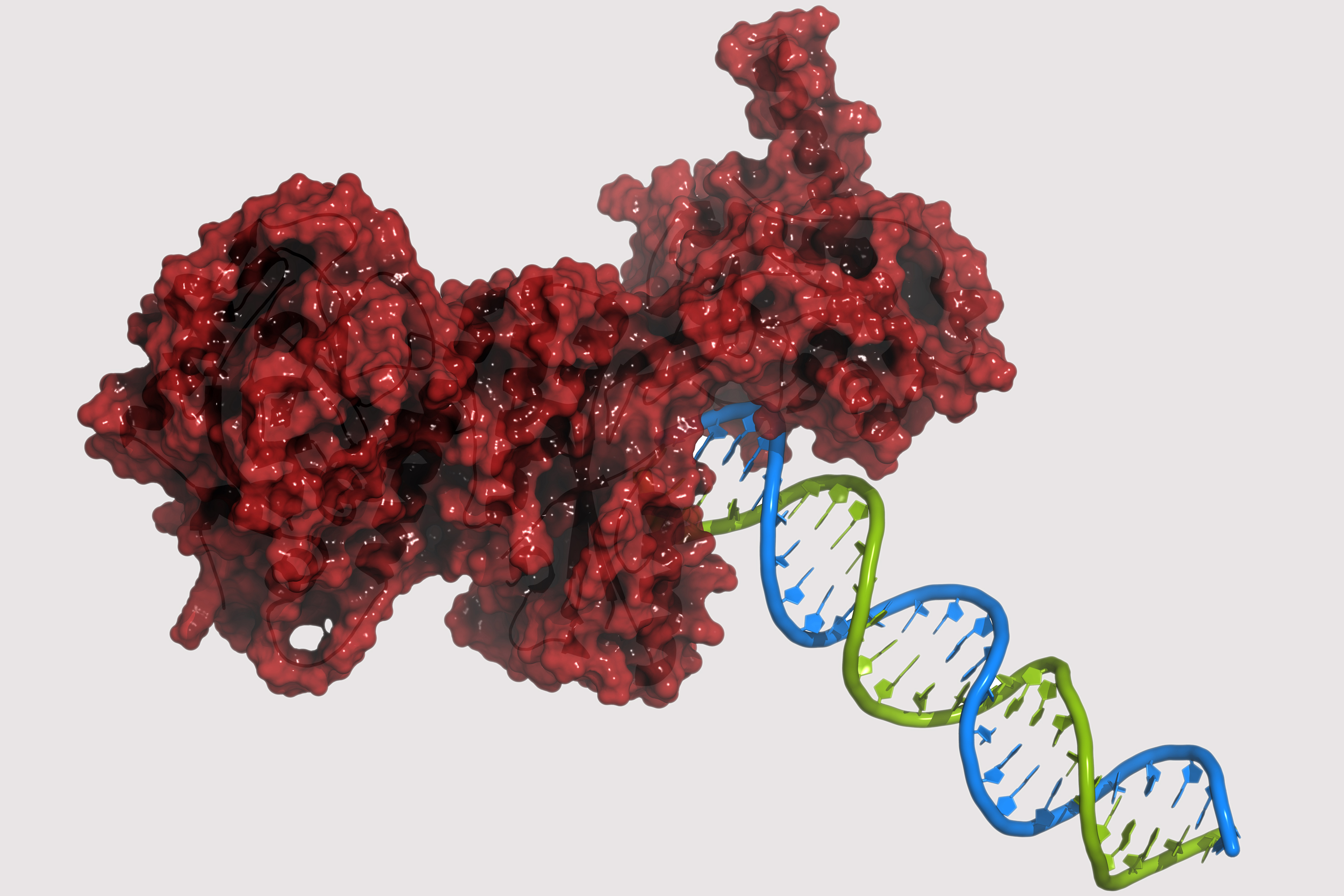
PARP1はDNA損傷を検知する最初の応答因子の1つとして作用し、修復経路の選択を補助する。PARP1はヒストンのADPリボシル化によるクロマチン構造の脱凝縮や、複数のDNA修復因子との相互作用や修飾によって修復の効率化に寄与する。PARP1は、ヌクレオチド除去修復、非相同末端結合、マイクロホモロジー媒介末端結合、相同組換え修復、DNAミスマッチ修復など、いくつかのDNA修復経路の調節に関与することが示唆されている。
PARP1は一本鎖DNA切断の修復に関与している。siRNAによるPARP1のノックダウンや低分子によるPARP1活性の阻害によって、一本鎖切断の修復は低下する。PARP1が存在しない場合、DNA複製の過程で複製フォークがこうした切断に遭遇することで複製フォークは停止し、その結果、二本鎖切断が蓄積する。こうした二本鎖切断は相同組換えを介して修復される。そのため、PARP1を欠く細胞はhyper-recombinagenic表現型(相同組換え頻度の増加など)を示し、このことはマウスにおいてin vivoでもpunアッセイによって観察されている。相同組換えが正常に機能している場合には、PARP1ヌル変異体(機能的なPARP1が存在しない細胞)は不健康な表現型を示さず、PARP1ノックアウトマウスでも不利な表現型や腫瘍形成の増加などは全く見られない。
炎症における役割
PARP1は、NF-κBによるTNFやIL-6、iNOSなど炎症性メディエーターの転写に必要である。PARP1の活性は多くの組織で年齢とともに増加する炎症性マクロファージに寄与する。PARP1によるHMGB1のADPリボシル化はアポトーシスを起こした細胞の除去を阻害し、それによって炎症を維持する。
喘息においては、PARP1はCD4 T細胞、好酸球、樹状細胞などの免疫細胞のリクルートと機能を促進する。
がんにおける過剰発現
PARP1はエラーが生じやすいDNA修復経路であるマイクロホモロジー媒介末端結合(MMEJ)に必要な6つの酵素のうちの1つである。MMEJは、欠失、転座、逆位やその他の複雑な再配置などの染色体異常と高頻度で関係している。PARP1がアップレギュレーションされている場合にはMMEJが増加し、ゲノム不安定性が引き起こされる。PARP1のアップレギュレーションとMMEJの増加はチロシンキナーゼ活性化型の白血病でみられる。
PARP1はプロモーターのETS結合部位がエピジェネティックに低メチル化状態となっているときにも過剰発現し、子宮体がん、BRCA(BRCA1/2)変異型卵巣がん、BRCA変異型漿液性卵巣がんのプログレッションに寄与している。
PARP1は他にも神経芽腫、HPV関連中咽頭がん、精巣やその他の生殖細胞の腫瘍、ユーイング肉腫、悪性リンパ腫、乳がん、結腸がんなど多数のがんで過剰発現している。
がん治療への応用
PARP阻害薬のがん治療における有効性の試験が行われている。PARP1阻害薬はBRCAness(BRCA遺伝子に変異がないにもかかわらず相同組換え修復異常がみられる状態)のがんに対して非常に有効な治療となる可能性があると考えられている。こうした腫瘍はPARP阻害薬に対する感受性が高い一方で、BRCA相同組換え経路が機能している健康な細胞に対しては有害な影響が及ばないためである。このことは、すべての細胞に対して毒性が高く、健康な細胞にDNA損傷を誘導して二次性のがんの形成をもたらす可能性がある従来型の化学療法とは対照的である。
老化
13種の哺乳類(ラット、モルモット、ウサギ、マーモセット、ヒツジ、ブタ、ウシ、ボノボ、ウシ、ロバ、ゴリラ、ゾウ、ヒト)の透過処理された単核白血球でPARP活性(主にPARP1によるもの)が測定されており、その活性はその種の最長寿命と相関していることが示されている。センテナリアン(100歳以上の高齢者)の血液試料から樹立されたリンパ芽球細胞株は、より若い(20歳から70歳)個人の試料に由来する細胞株よりも有意に高いPARP活性を示す。ヒトの早老疾患であるウェルナー症候群ではWRNタンパク質に欠陥がみられるが、PARP1とWRNはDNA切断のプロセシングに関与する複合体の一部を構成している。こうした事実は、長寿とPARPを介したDNA修復能力との関連を示唆している。さらに、PARPは活性酸素種の産生に対抗する作用を示し、DNAやタンパク質に対する酸化損傷を阻害することで長寿に寄与している可能性がある。
レスベラトロールはチロシルtRNAシンテターゼ(TyrRS)との相互作用を介して、PARP1を主要な機能標的としているようである。TyrRSはストレス条件下で核内へ移行して、PARP1のNAD 依存的なポリADPリボシル化を刺激する。その結果、PARP1はクロマチンの構造タンパク質からDNA損傷応答因子、転写調節因子へと機能が変化する。
PARP1のmRNAとタンパク質のレベルは転写因子ETS1の発現レベルによって部分的に制御されており、EST1はPARP1のプロモーター領域の複数のETS1結合部位と相互作用する。ETS1がPARP1のプロモーターにどの程度結合するかは、ETS1結合部位のCpGアイランドのメチル化状態に依存している。ETS1結合部位のCpGアイランドがエピジェネティックに低メチル化状態となっている場合には、PARP1の発現レベルが高くなる。
高齢者(69歳から75歳)由来の細胞では、PARP1とPARP2の恒常的発現レベルは若年成人(19歳から26歳)と比較して半分程度にまで低下している。しかしながら、センテナリアン(100歳から107歳)では、PARP1の恒常的発現レベルは若年と同等である。センテナリアンでみられるPARP1の高レベル発現は、過酸化水素による亜致死性のDNA酸化損傷に対する効率的な修復を可能にしていることが示されている。センテナリアンでみられるPARP1の高レベルの恒常的発現は、エピジェネティックな発現制御の変化によるものであると考えられている。
植物のPARP1
植物にも動物のPARP1とかなり類似したPARP1が存在し、DNA損傷、感染やその他のストレスに対する応答時のポリADPリボシル化の役割の研究が行われている。興味深いことに、シロイヌナズナArabidopsis thalianaでは(そしておそらく他の植物でも)、DNA損傷や病原性細菌に対する防御応答においてPARP1よりもPARP2がより大きな役割を果たしている。植物のPARP2の調節ドメインと触媒ドメインにはPARP1と中程度の類似性しか存在せず、また植物や動物のPARP1にはジンクフィンガー型DNA結合モチーフが存在するのに対し、PARP2のN末端にはSAP DNA結合モチーフが存在する。
相互作用
PARP1は次に挙げる因子と相互作用することが示されている。
出典
関連文献
- “Beyond DNA repair, the immunological role of PARP-1 and its siblings”. Immunology 139 (4): 428–37. (August 2013). doi:10.1111/imm.12099. PMC 3719060. PMID 23489378. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3719060/. Review of the subject.
関連項目
- 老化のDNA損傷理論
- 最長寿命
- オラパリブ – PARP阻害薬
- PARP阻害薬
- パータナトス
- ポリ(ADP-リボース)ポリメラーゼ
- 老化